10 jun Breve história das baterias
10
As baterias foram a principal fonte de eletricidade antes do desenvolvimento de geradores elétricos e redes elétricas, por volta do final do século XIX. Aperfeiçoamentos sucessivos na tecnologia de baterias facilitaram grandes avanços elétricos, desde os primeiros estudos científicos até o surgimento de telégrafos e telefones, levando a tecnologia a computadores portáteis, telefones celulares, carros elétricos e muitos outros dispositivos.
A Bateria de Bagdá é um conjunto de três artefatos — um pote de cerâmica, um tubo de cobre e uma barra de ferro — que foram encontrados no Iraque, datando de algum momento entre 150 a.C. e 650 d.C. Sua origem e propósito permanecem obscuros. Foi hipotetizado por alguns pesquisadores que o objeto funcionava como uma célula galvânica, possivelmente usada para galvanoplastia ou algum tipo de eletroterapia. Uma explicação alternativa é que ela funcionava como um recipiente de armazenamento para pergaminhos sagrados.
Cientistas e engenheiros desenvolveram vários tipos de baterias comercialmente importantes. “Células úmidas” eram recipientes abertos que continham eletrólito líquido e eletrodos metálicos. Quando os eletrodos eram completamente consumidos, a célula úmida era renovada substituindo os eletrodos e eletrólitos. Entretanto, vasos abertos não são adequados para uso móvel ou portátil, então, as células úmidas foram usadas comercialmente nos sistemas de telégrafo e telefone. Os primeiros carros elétricos usavam células úmidas semi-seladas.
Uma classificação importante para baterias é pelo seu ciclo de vida. As baterias “primárias” podem produzir corrente assim que fabricadas, mas, uma vez que os elementos ativos são consumidos, eles não podem ser recarregados eletricamente. O desenvolvimento da bateria de chumbo-ácido e subsequentes tipos “secundários” ou “recarregáveis” permitiram que a energia fosse restaurada para a célula, prolongando a vida útil das células permanentemente montadas. A introdução de baterias à base de níquel e lítio no século XX fez com que o desenvolvimento de inúmeros dispositivos eletrônicos portáteis fosse viável, desde lanternas potentes até telefones celulares. As baterias estacionárias de grande porte podem ser aplicadas no armazenamento de energia da rede (Energy Storage System), ajudando a estabilizar as redes de distribuição de energia elétrica.
Invenção
Em 1780, Luigi Galvani estava dissecando um sapo preso a um gancho de latão. Quando ele tocou sua perna com o bisturi de ferro, ela se contraiu. Galvani acreditava que a energia que impulsionava essa contração vinha da própria perna e inicialmente a chamou de “eletricidade animal”.
No entanto, seu amigo e colega cientista Alessandro Volta discordou, acreditando que este fenômeno foi causado por dois metais diferentes unidos por um intermediário úmido. Ele verificou essa hipótese através de um experimento e publicou os resultados em 1791. Em 1800, Volta inventou a primeira bateria verdadeira, que veio a ser conhecida como “pilha voltaica”., que consistia em pares de discos de cobre e zinco empilhados e intercalados, separados por uma camada de tecido ou papelão embebidos em salmoura (ou seja, o eletrólito). Ao contrário do frasco de Leyden (espécie primitiva de capacitor, inventada acidentalmente pelo holandês Pieter van Musschenbroek, em 1764), a pilha voltaica produzia uma eletricidade contínua e uma corrente estável, e perdia pouca carga ao longo do tempo em que não estava em uso, muito embora seus primeiros modelos não pudessem produzir uma tensão forte o suficiente para produzir faíscas. Volta experimentou vários metais e descobriu que o zinco e a prata davam os melhores resultados.

Os modelos de pilhas originais de Volta apresentavam algumas falhas técnicas. Uma delas era o vazamento de eletrólito, que causava curto-circuito devido ao peso dos discos comprimindo o pano embebido em salmoura. O escocês William Cruickshank resolveu o problema colocando os elementos em uma caixa, em vez de organizá-los em uma pilha. Tal configuração ficou conhecida como a “bateria da calha”.

Primeiras baterias práticas
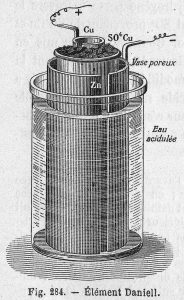
Célula de Daniell
O químico britânico John Frederic Daniell encontrou uma maneira de resolver o problema da bolha de hidrogênio na pilha voltaica usando um segundo eletrólito para consumir o hidrogênio produzido pelo primeiro. Em 1836, ele inventou a célula de Daniell, que consistia em um pote de cobre preenchido com uma solução de sulfato de cobre, na qual estava imerso um recipiente de barro não vidrado cheio de ácido sulfúrico e um eletrodo de zinco. A barreira de barro era porosa, o que permitia a passagem dos íons, mas impedia que as soluções se misturassem.
A célula de Daniell foi uma grande melhoria em relação à tecnologia existente usada nos primórdios do desenvolvimento de baterias e foi a primeira fonte prática de eletricidade. Ela forneceu uma corrente mais longa e confiável do que a célula voltaica, era mais segura e menos corrosiva. Ela tinha uma tensão operacional de aproximadamente 1,1 Volts. Logo se tornou o padrão da indústria para uso, especialmente com as novas redes de telégrafo.
A célula de Daniell também foi usada como padrão de trabalho para definição do Volt, que é a unidade de força eletromotriz utilizada até hoje.

Célula de Bird
Uma versão da célula de Daniell foi inventada em 1837 pelo médico Golding Bird do hospital de Guy em Londres. Ele usou uma barreira de gesso para manter as soluções separadas. Os experimentos de Bird com essa célula foram de alguma importância para a nova disciplina da eletrometalurgia.
Célula de vaso porosa
A versão porosa da célula de Daniell foi inventada por John Dancer, um fabricante de instrumentos de Liverpool, em 1838. Ela consiste de um anodo central de zinco mergulhado em um pote de barro poroso contendo uma solução de sulfato de zinco. O pote poroso é, por sua vez, imerso em uma solução de sulfato de cobre contida em uma lata de cobre, que age como o cátodo da célula. Mais uma vez, o uso de uma barreira porosa permite a passagem dos íons, mas impede que as soluções se misturem.
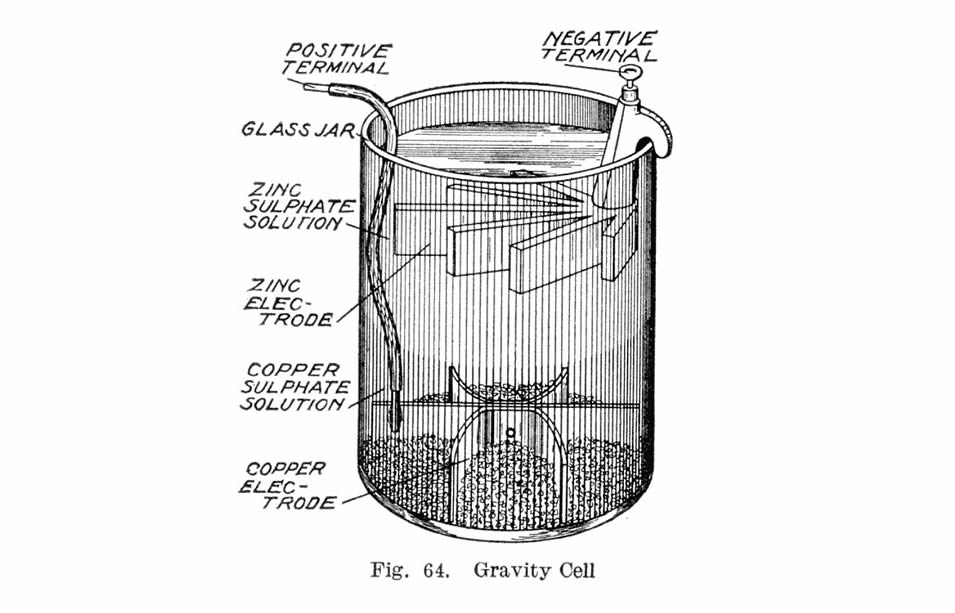
Célula Gravitacional
Na década de 1860, um francês chamado Callaud inventou uma variante da célula de Daniell chamada de “célula gravitacional”. Esta versão mais simples dispensa a barreira porosa. Isso reduziu a resistência interna do sistema e, assim, a bateria produziu uma corrente mais forte. Rapidamente se tornou a bateria de escolha para as redes de telégrafos americanos e britânicos, e foi usada até a década de 1950.
A célula gravitacional consistia de um frasco de vidro, no qual um catodo de cobre estava no fundo e um ânodo de zinco estava suspenso sob o aro. Cristais de sulfato de cobre seriam espalhados em torno do cátodo e, em seguida, o frasco seria preenchido com água destilada. À medida que a corrente era puxada, uma camada de solução de sulfato de zinco se formava no topo em torno do ânodo. Esta camada superior foi mantida separada da camada inferior de sulfato de cobre pela sua menor densidade e pela polaridade da célula.
A camada de sulfato de zinco era clara em contraste com a camada de sulfato de cobre azul profundo, o que permitia o técnico medir a duração da bateria visualmente. Por outro lado, essa configuração significava que a bateria poderia ser usada apenas em um dispositivo estacionário, caso contrário as soluções seriam misturadas ou derramadas. Outra desvantagem era que uma corrente tinha que ser continuamente extraída para evitar que as duas soluções se misturassem por difusão, o que a tornava inadequada para uso intermitente.

Célula de Poggendorff
O cientista alemão Johann Christian Poggendorff superou os problemas de separação do eletrólito e do despolarizador usando um pote de cerâmica porosa, em 1842. Na célula de Poggendorff, às vezes chamada de Célula Grenet (devido às obras de Eugene Grenet por volta de 1859), o eletrólito era ácido sulfúrico diluído e o despolarizador era ácido crômico. Os dois ácidos eram misturados fisicamente, eliminando o pote poroso. O eletrodo positivo (catodo) era de duas placas de carbono, com uma placa de zinco (negativa ou anodo) posicionada entre elas. Devido à tendência de a mistura ácida reagir com o zinco, foi usado um mecanismo para elevar o eletrodo de zinco dos ácidos.
A célula fornecia 1,9 Volts. Ela se mostrou popular entre os experimentadores por muitos anos devido a sua tensão relativamente alta, maior capacidade de produzir uma corrente consistente e ausência de vapores, mas a fragilidade relativa do seu fino invólucro de vidro e a necessidade de elevar a placa de zinco quando a célula não estava em uso acabaram por fazer com que este tipo de célula caísse em desuso. A célula também era conhecida como “célula de ácido crômico” e “célula de bicromato”. Este último nome veio da prática de produzir o ácido crômico pela adição de ácido sulfúrico ao dicromato de potássio, embora a própria célula não contivesse dicromato.
A célula Fuller foi desenvolvida a partir da célula de Poggendorff. Embora a química fosse essencialmente a mesma, os dois ácidos foram novamente separados por um recipiente poroso e o zinco foi tratado com mercúrio para formar um amálgama.
Célula Grove
A célula de Grove foi inventada pelo galês William Robert Grove em 1839. Ela consistia em um anodo de zinco mergulhado em ácido sulfúrico e um cátodo de platina mergulhado em ácido nítrico, separado por louça de barro porosa. Ela fornecia uma alta corrente e quase o dobro da tensão da célula de Daniell, o que a tornou a célula favorita das redes de telégrafo americanas por um tempo. No entanto, emitia vapores tóxicos de óxido nítrico quando operado e a tensão caía drasticamente à medida que a carga diminuía, o que a tornou um passivo, à medida que as redes de telégrafo se tornaram mais complexas. Além disso, a platina era muito cara.
Baterias Recarregáveis e Células Secas
Chumbo-ácido
Até este ponto, todas as baterias existentes seriam permanentemente drenadas quando todas as suas reações químicas fossem esgotadas. Em 1859, Gaston Planté inventou a bateria de chumbo-ácido, a primeira bateria que poderia ser recarregada passando uma corrente reversa através dela. Uma célula de chumbo-ácido consiste em um anodo de chumbo e um catodo de dióxido de chumbo imerso em ácido sulfúrico. Ambos os eletrodos reagem com o ácido para produzir sulfato de chumbo, mas a reação no anodo de chumbo libera elétrons enquanto a reação no dióxido de chumbo os consome, produzindo uma corrente. Essas reações químicas podem ser revertidas pela passagem de uma corrente reversa pela bateria, recarregando-a.
O primeiro modelo de Planté consistia em duas lâminas de chumbo separadas por tiras de borracha e enroladas em espiral. Suas baterias foram usadas pela primeira vez para acender as luzes em vagões de trem, enquanto parado em uma estação. Em 1881, Camille Alphonse Faure inventou uma versão melhorada que consistia de uma malha de grade de chumbo na qual uma pasta de óxido de chumbo era pressionada, formando uma placa. Várias placas podem ser empilhadas para maior desempenho e capacidade. Esse design foi mais fácil de produzir em massa.

Em comparação com outras baterias, a de Planté era bastante pesada e volumosa para a quantidade de energia que poderia armazenar. No entanto, podia produzir correntes notavelmente grandes em uso. Também tinha resistência interna muito baixa, o que significa que uma única bateria poderia ser usada para alimentar múltiplos circuitos.
A bateria de chumbo-ácido ainda é usada hoje em automóveis e outras aplicações onde o peso não é um fator essencial. Seu princípio básico não mudou desde 1859. No início da década de 1930, um eletrólito de gel (em vez de líquido, conhecido como “células gel”) produzido pela adição de sílica a uma célula carregada era usado na bateria de rádios portáteis para tubos a vácuo. Já na década de 1970, versões “seladas” se tornaram comuns (“VRLA” — Valve Regulated Lead-Acid, em inglês), permitindo que a bateria fosse usada em diferentes posições sem falhas ou vazamentos.
Hoje, as células são classificadas como “primárias” se produzirem uma corrente apenas até que seus reagentes químicos sejam exauridos e “secundárias” se as reações químicas puderem ser revertidas pela recarga da célula. A célula de chumbo-ácido foi a primeira célula “secundária”.
Célula de Leclanché
Em 1866, Georges Leclanché inventou uma bateria que consistia em um anodo de zinco e um catodo de dióxido de manganês envolto em um material poroso, mergulhado em um frasco de solução de cloreto de amônio. O cátodo de dióxido de manganês tinha um pouco de carbono misturado, o que melhorou a condutividade e absorção e fornecia uma tensão de 1,4 Volts. Esta célula alcançou um sucesso muito rápido em telegrafia, sinalização e operação em campainha elétrica.
A célula seca era usada para alimentar os telefones antigos — geralmente a partir de uma caixa de madeira adjacente afixada para acomodar as baterias antes que os telefones pudessem extrair energia da própria linha telefônica. Entretanto, a célula de Leclanché não podia fornecer uma corrente sustentada por muito tempo. Em longas conversas, a bateria descarregava, tornando a conversa inaudível. Isso ocorria porque certas reações químicas na célula aumentavam a resistência interna e, assim, diminuíam a tensão. Essas reações se invertiam quando a bateria era mantida inativa, o que a tornava adequada apenas para uso intermitente.
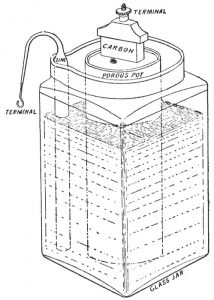
Célula de zinco-carbono, a primeira célula seca
Muitos pesquisadores tentaram imobilizar o eletrólito de uma célula eletroquímica para torná-lo mais conveniente de usar. A pilha de Zamboni de 1812 era uma bateria seca de alta tensão, mas capaz de fornecer apenas correntes mínimas. Vários experimentos foram feitos com celulose, serragem, vidro, fibras de asbesto e gelatina.
Em 1886, Carl Gassner obteve uma patente alemã sobre uma variante da célula de Leclanché, que veio a ser conhecida como célula seca porque não tinha um eletrólito líquido livre sequer. Em vez disso, o cloreto de amônio foi misturado com gesso para criar uma pasta, com uma pequena quantidade de cloreto de zinco adicionada para prolongar a vida em estoque. O cátodo de dióxido de manganês era mergulhado nesta pasta, e ambos eram selados em uma casca de zinco, que também atuava como anodo. Em novembro de 1887, ele obteve a patente norte-americana para o mesmo dispositivo.
Ao contrário das células úmidas anteriores, a célula seca de Gassner era mais sólida, não exigia manutenção, não derramava e podia ser usada em qualquer orientação. Ela fornecia um potencial elétrico de 1,5 Volts. O primeiro modelo deste tipo produzido em massa foi a célula seca Columbia, comercializada pela National Carbon Company, em 1896. O NCC melhorou o modelo de Gassner substituindo o gesso por papelão enrolado, uma inovação que deixou mais espaço para o cátodo e tornou a montagem da bateria mais fácil. Foi a primeira bateria conveniente para as massas, que tornou os dispositivos elétricos portáteis práticos e tornou possível a invenção da lanterna elétrica. A bateria de zinco-carbono (como veio a ser conhecida) ainda é fabricada hoje.
Em 1887, uma bateria seca foi desenvolvida por Yai Sakizō no Japão, então patenteada em 1892. Em 1893, esta bateria seca foi exposta na Exposição Mundial da Colômbia e recebeu considerável atenção internacional.
NiCd, a primeira bateria alcalina
Em 1899, um cientista sueco chamado Waldemar Jungner inventou a bateria de níquel-cádmio, uma bateria recarregável que tinha eletrodos de níquel e cádmio em uma solução de hidróxido de potássio, a primeira bateria a usar um eletrólito alcalino. Passou a ser comercializada na Suécia a partir de 1910 e chegou aos Estados Unidos em 1946. Os primeiros modelos eram robustos e tinham densidade de energia significativamente melhor do que as baterias de chumbo-ácido, mas eram muito mais caros.
Século 20: novas tecnologias
Níquel-ferro
Jungner havia inventado uma bateria de níquel-ferro em 1899, no mesmo ano em que sua bateria de NiCd, mas descobriu que ela era inferior à sua contraparte de cádmio e, como consequência, nunca se incomodou em patentear. Apesar de ser uma tecnologia mais barata, produzia muito mais gás hidrogênio ao ser carregada, o que significava que não podia ser selada, e o processo de carregamento era menos eficiente. Thomas Edison se apropriou do design de bateria de níquel-ferro da Jungner, patenteou-o e o vendeu em 1903. Edison queria comercializar um substituto mais leve e durável para a bateria de chumbo-ácido que alimentava alguns dos primeiros automóveis, e esperava que, ao fazê-lo, os carros elétricos se tornassem o padrão, com sua empresa como principal fornecedor de baterias. No entanto, os clientes descobriram que seu primeiro modelo de bateria era propenso a vazamentos e não superou a célula de chumbo-ácido em termos de vida útil. Embora Edison tivesse sido capaz de produzir um modelo mais confiável e poderoso sete anos depois, o barato e confiável Modelo T da Ford já havia transformado em padrão os carros a gasolina. Por outro lado, a bateria da Edison obteve grande sucesso em outras aplicações, como veículos ferroviários elétricos e diesel-elétricos, fornecendo energia de reserva para sinais de cruzamento de ferrovias ou para as lâmpadas usadas em minas.

Pilhas alcalinas comuns
Até o final da década de 1950, a bateria de zinco-carbono continuava a ser uma bateria popular de células primárias, mas sua vida útil relativamente baixa prejudicava as vendas. Em 1955, o engenheiro canadense Lewis Urry, trabalhando para a Union Carbide no Laboratório de Pesquisa Parma da National Carbon Company, foi encarregado de encontrar uma maneira de estender a vida útil das baterias de zinco-carbono, mas Urry percebeu que as baterias alcalinas eram mais promissoras. Até então, baterias alcalinas de maior duração eram invariavelmente caras. A bateria de Urry consistia de um cátodo de dióxido de manganês e um ânodo de zinco em pó com um eletrólito alcalino, com maior área de superfície. Essas baterias chegaram ao mercado em 1959.

Níquel-hidrogênio e níquel metal-hidreto
A bateria de níquel-hidrogênio entrou no mercado como um subsistema de armazenamento de energia para satélites de comunicação comercial.
As primeiras baterias de níquel metal-hidreto (NiMH) de consumo para aplicações menores surgiram no mercado em 1989 como uma variação da bateria de níquel-hidrogênio dos anos 70. Baterias NiMH tendem a ter vida útil mais longa do que as baterias NiCd (e seu tempo de vida continua aumentando à medida que os fabricantes experimentam novas ligas) e, como o cádmio é tóxico, as baterias NiMH são menos prejudiciais ao meio ambiente.
Baterias de lítio e íons de lítio
O lítio é o metal com menor densidade e com maior potencial eletroquímico e relação energia-peso. O baixo peso atômico e o pequeno tamanho de seus íons também aceleram sua difusão, sugerindo que seria um material ideal para as baterias. Em 1912, o físico-químico americano Gilbert Newton Lewis começou a experimentação com baterias de lítio, mas sua versão comercial não chegou ao mercado até a década de 1970. Células primárias de lítio de 3 Volts, como o tipo CR123A e células de botão de 3 Volts, ainda são amplamente usadas, especialmente em câmeras e dispositivos muito pequenos.
Três desenvolvimentos importantes marcaram a década de 1980. Em 1980, o químico americano John B. Goodenough descobriu o cátodo LiCoO2 (terminal positivo) e o cientista marroquino Rachid Yazami descobriu o anodo de grafite (terminal negativo) com o eletrólito sólido. Em 1981, os químicos japoneses Tokio Yamabe e Shizukuni Yata descobriram um novo nanocobaleno-PAS (poliaceno), muito eficaz para o anodo no eletrólito líquido convencional. Isso levou uma equipe de pesquisa gerenciada por Akira Yoshino da Asahi Chemical, no Japão, a construir o primeiro protótipo de bateria de íons de lítio em 1985, uma versão recarregável e mais estável da bateria de lítio. A Sony passou a comercializar a bateria de íons de lítio em 1991.
Em 1997, a bateria de polímero de lítio foi lançada pela Sony e pela Asahi Kasei. Essas baterias mantêm seu eletrólito em um composto de polímero sólido em vez de em um solvente líquido, e os eletrodos e separadores são laminados entre si. Esta última diferença permite que a bateria seja envolta num invólucro flexível em vez de um invólucro de metal rígido, o que as tornam moldáveis para se ajustarem a diversos dispositivos. Essa vantagem favoreceu as baterias de polímero de lítio no projeto de dispositivos eletrônicos portáteis, como telefones celulares, assistentes digitais pessoais e aeronaves controladas por rádio, já que tais baterias permitem um design mais flexível e compacto. Eles geralmente têm uma menor densidade de energia do que as baterias normais de íons de lítio.

As baterias continuam em constante desenvolvimento, em um mundo que demanda cada vez mais geração, transmissão e armazenamento de energia. Entretanto, um conceito ou uma pesquisa científica pode levar uma década ou mais para que se torne um produto comercialmente viável. O melhor tipo de bateria é definido pelas restrições de cada projeto (custo, espaço, temperatura, etc.) e pela sua aplicação.
Continue acompanhando nosso blog para conhecer mais sobre o mundo das baterias!
